LA GRAN MENTIRA: “AYUDAR A LA NATURALEZA, CAMBIANDO SU COMPOSICION”
LA GRAN MENTIRA: “AYUDAR A LA NATURALEZA, CAMBIANDO SU COMPOSICION”
(Dr. Carlos Alberto Romero Batallan. Doctor Ingeniero Químico; Licenciado en Ciencias Químicas y Máster en Medio Ambiente.)
1. CONSIDERACIONES PREVIAS AL ESTUDIO
Por casualidad cayó en mis manos, una de las últimas cartas encíclicas de su Santidad el Papa Francisco, que bajo el título” LAUDATO SI” del Santo Padre Francisco cuyo contenido incide en algunas consideraciones “SOBRE EL CUIDADO DE LA CASA COMUN”.
¡¡Y me hizo pensar¡¡. Una vez leída la mencionada encíclica, me pregunte: ¿que debería hacer yo, desde mis conocimientos en Ciencias Químicas y en Ciencias Medio Ambientales?
Me llamó mucho la atención, el párrafo que literalmente expongo y que podría comprobar con los medios con que cuenta mi laboratorio personal. El párrafo se refiere al explicar en el apartado “I. Contaminación y cambio climático. Contaminación, basura y cultura del descarte”, cómo los seres humanos estamos” ACIDIFICANDO LA TIERRA”. Los transcribo tal cual a continuación:
“20.Existen formas de contaminación que afectan cotidianamente a las personas. La exposición a los contaminantes atmosféricos produce un amplio espectro de efectos de salud, especialmente de los más pobres, provocando millones de muertes prematuras. Se enferman, por ejemplo, a causa de la inhalación de elevados niveles de humo que procede de los combustibles que utilizan para cocinar o para calentarse. A ello se suma la contaminación que afecta a todos, debida al transporte, al humo de la industria, a los depósitos de sustancias que contribuyen a la acidificación del suelo y del agua, a los fertilizantes, insecticidas, fungicidas, controladores de malezas y agrotóxicos en general. La tecnología que, ligada a las finanzas, pretende ser la única solución de los problemas, de hecho, suele ser incapaz de ver el misterio de las múltiples relaciones que existen entre las cosas, y por eso a veces resuelve un problema creando otros”.
A la vista de lo reseñado en la encíclica” LAUDATO SI”, me surge una gran pregunta y es ¿Los científicos y en especial, los investigadores agrarios, son conscientes y saben porque se está “ACIDIFICANDO LA TIERRA”? O, dicho de otra manera, ¿Por qué ESTAMOS ACIDIFICANDO LA TIERRA”?
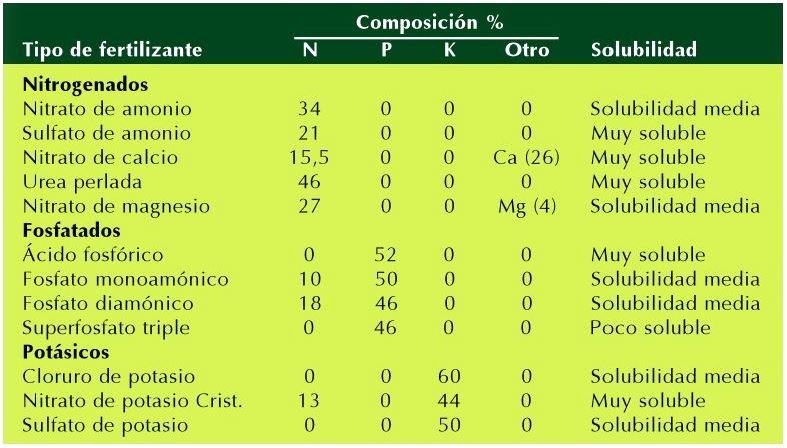
Tratando de buscar el porqué de tal acción, y siguiendo las pistas que me daba la encíclica Papal. Y… Oh ¡casualidad ¡ cae en mis manos la relación de compuestos químicos, que se reseñan en el cuadro siguiente y se les atribuye el calificativo de “Tipo de fertilizante”:
A la vista del cuadro, observamos los siguientes “Errores técnicos”:
- Se denominan “Tipo de fertilizante” a compuestos químicos; que no lo son; y sí solutos, dado que intervienen como tales, en los aportes de compuestos inorgánicos, denominados” Fertilizantes Inorgánicos”, para la formación de fertilizantes denominados “N-P-K” ( Contenidos en: Nitrógeno, Fosforo y Potasio).
- Se centra exclusivamente en determinar, hasta qué grado de concentración puede aportar cada uno de los compuestos en % de: N (nitrógeno); P (fosforo); K (potasio) y Otros.
- Ambiguamente, determina la solubilidad que tienen los distintos compuestos químicos en el agua. Denominándoles como: Poco soluble; solubilidad media y muy soluble.
2. CARACTERISTICAS DE LOS COMPUESTOS DENOMINADOS FERTILIZANTES
2.1. CLASIFICACION/DENOMINACION
2.1.1. COMPUESTOS NITROGENADOS
Según el cuadro anteriormente reseñado, denomina como “Tipo de fertilizante Nitrogenados” a los siguientes compuestos químicos; los cuales aportan nitrógeno, a los mal llamados diluyentes y que son, los realmente, “fertilizantes inorgánicos”: Nitrato de amonio (NH 4) NO3; Sulfato de amonio (NH4)2SO4; Nitrato de calcio Ca (NO3)2; Urea perlada CO (NH2)2 y Nitrato de magnesio Mg (NO3)2.
2.1.2. COMPUESTOS FOSFATADOS
Los compuestos reseñados en el cuadro como compuestos químicos (solutos) que aportan fosforo al ser diluidos en agua son: Ácido fosfórico H3PO4 ; Fosfato mono amónico (NH4)H2PO4; Fosfato di amónico (NH4)2H2PO4 y Superfosfato triple Ca(H2PO4)2.
2.1.3. COMPUESTOS POTÁSICOS
Se denominan y se reflejan en el cuadro los siguientes compuestos químicos: Cloruro potásico KCl; Nitrato de potasio KNO3; Sulfato de potasio K2SO4.
2.2 ANALISIS DE LOS COMPUESTOS QUIMICOS DENOMINADOS FERTILIZANTES
Se procedió en el laboratorio a realizar las diluciones en agua destilada de cada uno de los solutos de los compuestos químicos que figuran en el cuadro y una vez disueltos, se procedió a medir su pH para comprobar su grado de acidez.
2.2.1. COMPUESTOS NITROGENADOS
2.2.1.1. NITRATO DE AMONIO: NH4 NO3
- NH4 NO3 + H2O NH4+ + NO3–
- NH4+ NH3 + H+
- NO3– + H2O HNO3 + OH–
Se procedió a tomar de su continente (frasco), una cantidad de 1,153 g de producto y diluirlo en 44 cc de agua destilada. Una vez disuelto y confirmada su solubilidad media (cierta dificultad en realizar la dilución) procedimos a realizar la medición de su pH y reseñamos sus valores.
Peso del soluto (Nitrato de Amonio) = 1,153g
Peso del disolvente (Agua destilada) = 44,310 cc
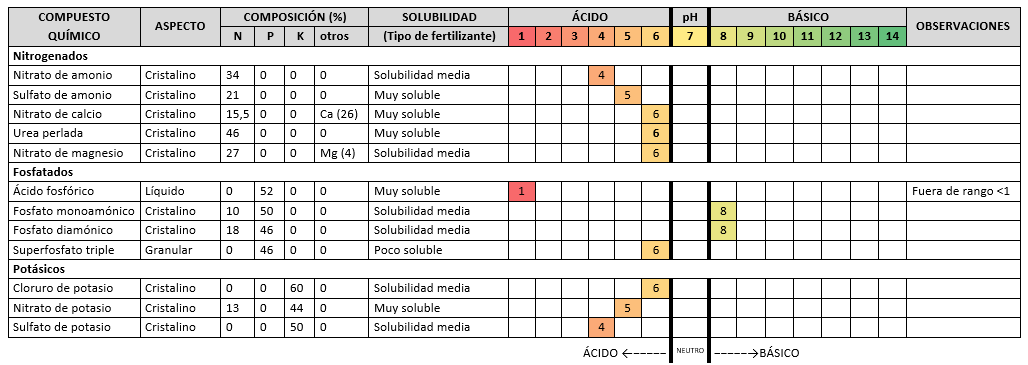
pH = 4,42 Carácter: ÁCIDO
2.2.1.2. SULFATO DE AMONIO: (NH4)2 SO4
- (NH4)2 SO4 + H2O 2NH4+ + SO42-
- NH4+ NH3 + H+
- SO42- + H2O H2SO4 + OH–
La muestra del compuesto químico fue tomada de un frasco cuya caducidad era el 30/09/2020. De fácil dilución en agua destilada (muy soluble). Tomamos 6g de soluto (sulfato de amonio) y lo diluimos en 100cc de agua destilada y reseñamos el resultado.
Peso de soluto (Sulfato de Amonio)= 6 g
Peso disolvente (agua destilada) = 100 cc
pH = 5,39 Carácter: ÁCIDO
2.2.1.3. NITRATO DE CALCIO: Ca (NO3)2
- Ca (NO3)2 Ca2+ + 2NO3–
- Ca2+ + 2H2O Ca (OH)2 + 2H+
- NO3– + H2O HNO3 + OH–
Muy soluble en agua destilada. Solido blanco .Tomamos una muestra de soluto (Nitrato de Calcio) y lo diluimos en el disolvente (agua destilada) y posteriormente se midió su pH.
Peso de soluto (Nitrato de Calcio) = 1,774 g
Peso disolvente (Agua destilada) =47,441
pH = 6,45 Carácter: ÁCIDO
2.2.1.3. UREA PERLADA: CO (NH2)2
- pH>6,3 ==> CO (NH2)2 + H+ + 2H2O 2NH4+ + HCO3–
- pH<6,3 ==> CO (NH2)2 + 2H+ + 2H2O 2NH4+ + CO2 + H2O
- NH4+ NH3 + H+
La hidrólisis de la urea aumenta el pH del entorno (consumo de H+) y además favorece la volatilización del NH3 a la atmósfera.
De aspecto solido blanco. Muy soluble en agua. Se procedió a tomar 1,206 g de muestra y diluirla en 43 cc de agua destilada, midiéndose seguidamente su pH.
Peso de soluto = 1,963 g
Peso del disolvente ( agua destilada)= 47,886 g
pH= 6,66 Carácter: ÁCIDO
22.1.3. NITRATO DE MAGNESIO: Mg NO3
- Mg (NO3)2 Mg2+ + 2NO3–
- Mg2+ + 2H2O Mg (OH)2 + 2H+
- NO3– + H2O HNO3 + OH–
Solido granular. De solubilidad media. Tomamos del producto 1,933 g y lo diluimos en 49,513 g de agua destilada. Una vez diluido se procedió a medir su pH. Reflejamos los datos y resultado obtenido.
Peso de soluto= 1,933 g
Peso del disolvente (agua destilada)= 49,513 cc.
pH= 5,97 Carácter: ÁCIDO
2.2.2. COMPUESTOS FOSFATADOS:
Aquellos compuestos químicos, que son los que aportan a los fertilizantes inorgánicos, el elemento químico denominado Fósforo (P).
2.2.2.1. ÁCIDO FOSFÓRICO: H3PO4
- H3PO4 H2PO4– + H+
Realizamos la medición de su pH, sobre una muestra de ácido fosfórico diluido al 85% .Se preparo la dilución bajo los siguientes parámetros:
Peso del soluto = 3 cc de ácido fosfórico (H3PO4) al 85%
Peso del disolvente = 47cc de agua destilada.
pH<1 Se sitúa fuera del rango de medida del peachimetro. Por lo tanto, de carácter: SUPERÁCIDO.
2.2.2.2. FOSFATO MONOAMÓNICO: (NH4) H2PO4
- (NH4) H2PO4 + H2O NH4+ + H2PO4–
- NH4+ NH3 + H+
- H2PO4– + H2O H3PO4 + OH–
De aspecto solido granular de color blanco. Procedimos a su dilución en agua destilada de fácil dilución, procediéndose seguidamente a medir su pH .
Peso del soluto= 1,365 g
Peso del disolvente (Agua destilada)= 32,27 g
pH= 8,39 De carácter: BÁSICO
2.2.2.3. FOSFATO DIAMÓNICO: (NH4) HPO4
- (NH4)2 HPO4 + H2O 2NH4+ + HPO42-
- NH4+ NH3 + H+
- HPO42- + H2O H2PO4– + OH–
Aspecto solido granular de color blanco. Se procedió a su dilución en agua destilada y se midió su pH utilizando un peachimetro.
Peso del soluto= 1,458 g
Peso del disolvente (Agua destilada)= 43,336cc
pH= 8,31 De carácter: BÁSICO
2.2.2.4. SUPERFOSFATO TRIPLE: Ca (H2PO4)2
- Ca (H2PO4)2 + H2O Ca2+ + H2PO4–
- Ca2+ + H2O Ca (OH)2 + H+
- H2PO4– + H2O H3PO4 + OH–
Solido de aspecto granular de color gris. Comprobamos su poca solubilidad en agua destilada. Preparamos una dilución compuesta de:
Peso del soluto= 6 g
Peso del disolvente ( Agua destilada)= 94 cc
pH= 6,61 De carácter: ÁCIDO
2.2.3. COMPUESTOS POTÁSICOS
2.2.3.1.CLORURO DE POTASIO: KCl
- KCl + H2O K+ + Cl–
- K+ + H2O KOH + H+
- Cl– + H2O HCl + OH–
Procedimos a disolver el producto, de color blanco, de solubilidad media, en agua destilada para posteriormente medir su pH
Peso del soluto= 6 g
Peso del disolvente (Agua destilada) = 100 cc
pH=6,46 De carácter: ÁCIDO
2.2.3.2. NITRATO DE POTASIO CRISTALINO: KNO3
- KNO3 + H2O K+ + NO3–
- K+ + H2O KOH + H+
- NO3– + H2O HNO3 + OH–
Se procedió a disolver el producto en agua destilada, de muy fácil dilución, y posteriormente procedimos a medir su pH.
Peso del soluto= 6 g
Peso del disolvente (Agua destilada) = 100cc
pH= 5,42 De carácter: ÁCIDO
2.2.3.3. SULFATO DE POTASIO: K2SO4
- K2SO4 + H2O 2K+ + SO42-
- K+ + H2O KOH + H+
- SO42- + 2H2O H2SO4 + 2OH–
Procedimos a disolver en agua destilada 1,374 g de soluto ( Sulfato de potasio) solido de color blanco en 43,863cc de agua destilada y posteriormente se procedió a medir su pH mediante peachimetro.
Peso del soluto = 1,374 g
Peso del disolvente ( Agua destilada) = 43, 863 cc
pH= 4,38 De carácter: ÁCIDO
3 CUADRO RESUMEN COMPORTAMIENTO COMO FERTILIZANTES INORGÁNICOS
4 ACCIONES Y CONCLUSIONES
A la vista de lo anteriormente descrito, tengo a bien realizar las siguientes conclusiones y/o acciones a proponer:
4.1.- Se demuestra que los mal llamados “Fertilizantes Inorgánicos” y sí compuestos químicos, actúan como solutos, para aportar diluidos en agua los elementos que necesita la tierra y que son: Nitrógeno (N), Fósforo (P) y Potasio (K) todos ellos con carácter ácido, excluidos, el Fosfato Monoamónico (NH4)H2PO4 y el compuesto químico Fosfato Diamónico (NH4)2 HPO4 que en la elaboración tienen carácter básico. Aportando “ACIDEZ”, si son utilizados como solutos en la elaboración de los Fertilizantes Inorgánicos, a los suelos de “nuestro planeta” hogar de todos los seres vivos.
4.2.- No podemos ignorar como científicos que somos, que dichos componentes inorgánicos, dada su acidez, pueden estar alterando el Orden de la Naturaleza ayudando a acidificar su estado sólido.
4.3.- Hay que tratar de devolverle a la Naturaleza todo lo que nos sobra, en forma de productos que proceden de los restos de materia orgánica que son desechados para el consumo humano y nos permite después de biometanizarlos y/o compostarlos, devolvérselos al suelo en forma de compost y/o abonos orgánicos naturales previa su fermentación aerobia y anaerobia.
4.4.- Seria interesante divulgar la información científica que se tiene, tratando de hacer llegar a los agricultores los conocimientos de cara a que sepan con lo que se están enfrentando y no violentar a la Naturaleza con aportes de fertilizantes de carácter eminentemente ácido.
Y para que así conste, firmo el presente estudio en Madrid a 20 de noviembre de 2019
| Fdo.: Dr. Carlos Romero Batallán
Doctor en Ingeniería Química Ldo. en CC. Químicas Col Nº 1917 Diplomado en Plásticos Máster en Medio ambiente D.E.A. en Ciencias e Ingeniería del Medio Ambiente Perito Judicial |













Dejar un comentario
¿Quieres unirte a la conversación?Siéntete libre de contribuir!